- 環境・エネルギー
- 電子部品/半導体
同種細胞治療-治療における新たなモダリティ
細胞治療とは、損傷した組織や以前損なわれていた組織を補うために、活性のある健康な細胞を患者の体内に導入することである。細胞治療に使用される細胞は、患者自身の体から採取されたもの(自家細胞)、またはドナーから採取されたもの(同種細胞)である。同種細胞療法では、細胞は(所望の治療反応を引き起こ すように)操作され、体外で増幅される。改変された細胞は細胞バンクに保存されるか、患者に投与される。再生医療アライアンスによると、同種細胞を用いたがん治療の臨床試験数は過去5年間で30%増加した。
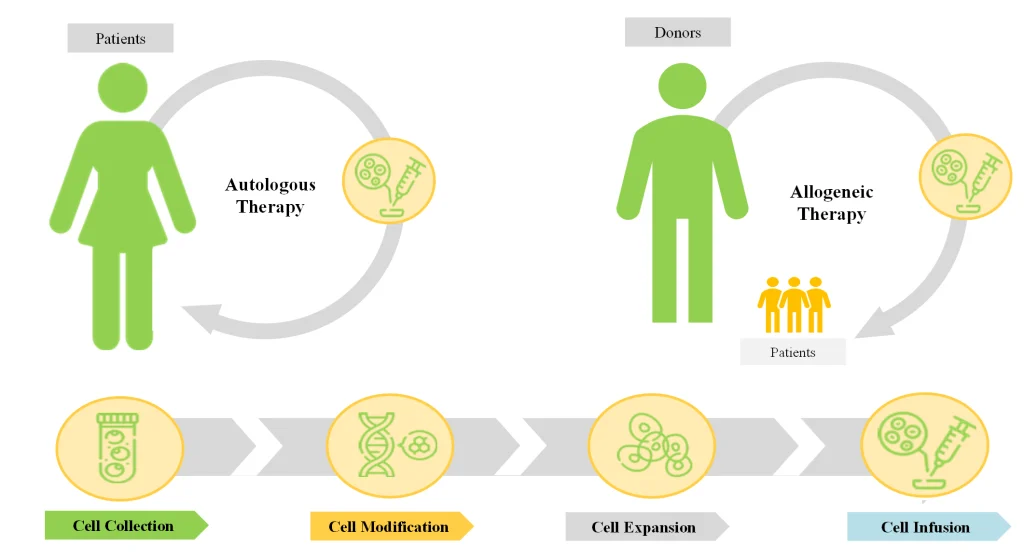
同種細胞療法は、脂肪組織、骨髄、末梢血、胎盤、幹細胞、臍帯など、さまざまな供給源から得られる。
同種細胞治療の種類
同種細胞療法は以下の種類に分類される:

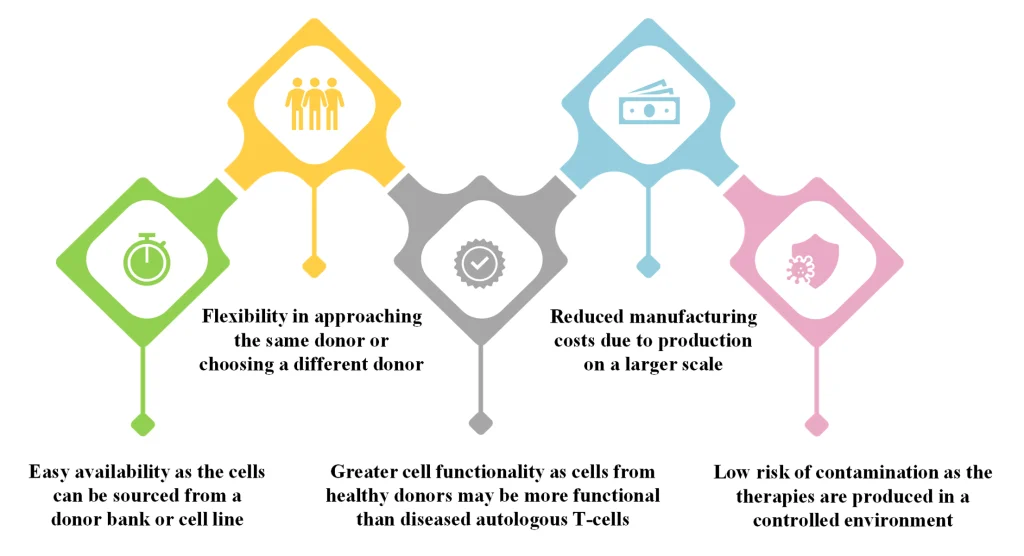
同種細胞治療の利点
同種細胞療法は他の細胞療法と比較して様々な利点があり、自己免疫疾患、癌、遺伝性疾患、感染症など様々な疾患の治療に有望なアプローチである。
本レポートに掲載されている主要企業は、Artiva Biotherapeutics、Allogene Therapeutics、Atara Biotherapeutics、Cellenkos、Cell2Cure、Celularity、Cellular Biomedicine Group、CHABiotech、CRISPR Therapeutics、Fate Therapeuticsです。
同種細胞治療領域における最近の動向
2022年12月、欧州委員会は、エプスタイン・バーウイルス陽性の移植後リンパ増殖性疾患(EBV+ PTLD)の治療薬として、初の同種T細胞免疫療法であるEbvallo(Atara Biotherapeutics社が開発)を承認した。
2022年12月、米国FDAはCB-010(Caribou Biosciences社が開発)を再発・難治性のB細胞性非ホジキンリンパ腫の治療薬としてファスト・トラック指定した。
2022年9月、米国FDAはCTX130(CRISPR Therapeutics社が開発)を皮膚T細胞リンパ腫の治療薬としてRegenerative Medicine Advanced Therapy(RMAT)に指定した。
2022年7月、米国FDAは、再発または難治性のT細胞性急性リンパ芽球性白血病/リンパ芽球性リンパ腫の治療薬として、WU-CART-007(Wugen社が開発)をファストトラック指定および希少小児疾患指定(RPDD)に指定した。
2022年4月、米国FDAはALLO-605(Allogene Therapeutic社が開発)を進行性多発性骨髄腫の治療薬として希少疾病用医薬品に指定した。
将来の展望
同種細胞療法は、単一の細胞供給源で複数の患者を治療できる既製の治療法であり、悪性疾患だけでなく非悪性疾患に対しても有効な治療選択肢として存続している。これらの治療法は現在、さまざまな研究(前臨床および臨床)で研究されており、さまざまな法域で承認もされている。さらに、患者にとってより安全で、希少疾患の領域ではより商業的に実現可能な治療法となる可能性が高い。
執筆者:Simran Kaur(Roots Analysis社)
お問合せ:Roots Analysisに関するお問合せはデータリソース(office@dri.co.jp)までご連絡下さい。

